Tính pH của dung dịch hỗn hợp CH3COOH 0,1M và CH3COONa 0,1M. Biết rằng ở một nhiệt độ xác định t°C có K a C H 3 C O O H = 1 , 8 . 10 - 5
A. 1
B. 1,745
C. 1,754
D. 1,7
Dung dịch có chứa CH3COOH 0,1M và CH3COONa 0,1M. Tính độ pH của dung dịch. Biết rằng hằng số axit của CH3COOH là Ka = 10-4,76.
Sửa đề bài Vì CH3COONa là chất điện li mạnh nên được viết trước để tạo môi trường cho cân bằng của chất điện li yếu phân li và cân bằng:
CH³COOH ⇔ CH³COO -+H+
Ban đầu 0,1 0. 0
Phân li xM x. x
Cân bằng 0,1-x 0,1+x x
Suy ra K = \(\dfrac{x(x+0,1)}{0,1-x}\) = 1,8.10 mũ âm ⁵
⇒ x = 1,8 . 10 mũ âm ⁵
⇒pH = log x = 1745
Thêm 0,001mol HCI vào 1 lít dung dịch hỗn hợp CH3COONa 0,1M và CH3COOH 0,1M thì pH dung dịch thu được là bao nhiêu?
Cho dung dịch X chứa hỗn hợp gồm CH3COOH 0,1 M và CH3COONa 0,1 M. Biết ở 25°C, K của CH3COOH là 1,75.10-5 và bỏ qua sự phân li của nước. Giá trị pH của dung dịch X ở 25°C là:
A. 1,00
B. 4,24
C. 2,88
D. 4,76
Vì muối CH3COONa là chất điện li mạnh nên ta có
![]()
Do đó sau quá trình trên trong dung dịch có nồng độ của ion CH3COO- là 0,1.
Xét cân bằng điện li: CH3COOH + H2O ⇌ CH3COO- + H3O+
Nồng độ ban đầu: 0,1 0,1 0
Nồng độ phân li: x(M) → x x
Nồng độ cân bằng: 0,1 – x 0,1 + x x
Thay các giá trị ở trạng thái cân bằng vào công thức tính hằng số điện li thì ta có
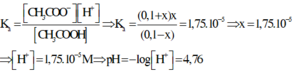
Đáp án D.
Trộn 100ml dung dịch CH3COOH 1M với 100ml NaOH 0,6M thu được dung dịch X. Biết ở nhiệt độ xác định K b C H 3 C O O - = 5 , 5 . 10 - 10 . Hãy tính pH của dung dịch X ở nhiệt độ xác định trên.
A. 4,98
B. 4,89
C. 4,29
D. 4,92
Dung dịch CH3COOH 0,1M có độ điện li α = 1%. Tính pH của dung dịch thu được.
A.1
B.2
C. 3
D. Đ/a khác
Trộn 100ml dung dịch hỗn hợp gồm H2SO4 0,05M và HCl 0,1M với 100ml dung dịch hỗn hợp gồm NaOH 0,2M và Ba(OH)2 0,1M thu được dung dịch X. Tính pH của dung dịch X?
A. 8
B. 14
C. 12
D. 13
Đáp án C
nH+ = 0,02 mol; nOH-= 0,04 mol
H+ + OH- → H2O
0,02 0,04
nOH- dư = 0,02 mol; [OH-] dư = 0,02/0,2 = 0,1M suy ra [H+] = 10-13 M suy ra pH = 13
Trộn 100 ml dung dịch hỗn hợp gồm H2SO4, 0,05M và HCL 0,1M với 100 ml dung dịch hỗn hợp NaOH 0,2M và Ba(OH)2 0,1M, được dung dịch X. Tính giá trị pH của dung dịch X và tính khối lượng kết tủa thu được.
`100mL=0,1L`
`n_{H^+}=0,1.0,05.2+0,1.0,1=0,02(mol)`
`n_{SO_4^{2-}}=0,1.0,05=0,005(mol)`
`n_{OH^-}=0,1.0,2+0,1.0,1.2=0,04(mol)`
`n_{Ba^{2+}}=0,1.0,1=0,01(mol)`
`Ba^{2+}+SO_4^{2-}->BaSO_4`
Do `0,01>0,005->` Tính theo `SO_4^{2-}`
`n_{BaSO_4}=n_{SO_4^{2-}}=0,005(mol)`
`->m_↓=0,005.233=1,165(g)`
`H^{+}+OH^{-}->H_2O`
Do `0,02<0,04->OH^-` dư
`n_{OH^{-}\ pu}=n_{H^+}=0,02(mol)`
`->n_{OH^{-}\ du}=0,04-0,02=0,02(mol)`
Trong X: `[OH^-]={0,02}/{0,1+0,1}=0,1M`
`->pH=14-pOH=14+lg[OH^-]=13`
PT: \(NH_3+H_2O⇌NH_4^++OH^-\)
Bđ: 0,1 0 0 (M)
Pư: x x x (M)
Cb: 0,1 - x x x (M)
Ta có:
\(\dfrac{\left[NH_4^+\right]\left[OH^-\right]}{\left[NH_3\right]}=K_c\) \(\Rightarrow\dfrac{x.x}{0,1-x}=1,74.10^{-5}\Rightarrow x\approx1,31.10^{-3}\left(M\right)\)
⇒ pH = 14 - (-log[OH-]) = 11,12
Để chuẩn độ 20ml dung dịch hỗn hợp HCl 0,1M và HNO3 aM cần dùng dung dịch hỗn hợp KOH 0,1M và Ba(OH)2 0,05M. Giá trị của a là:
A. 0,08
B. 0,07
C. 0,068
D. 0,065
Đáp án: D
nH+ = 0,002+0,02a
nOH- = 0,0033
Vì nH+= nOH-
ð a= 0,065